Forschungsprojekte
Technologien
Algorithmus-unterstütztes Enzym-Engineering
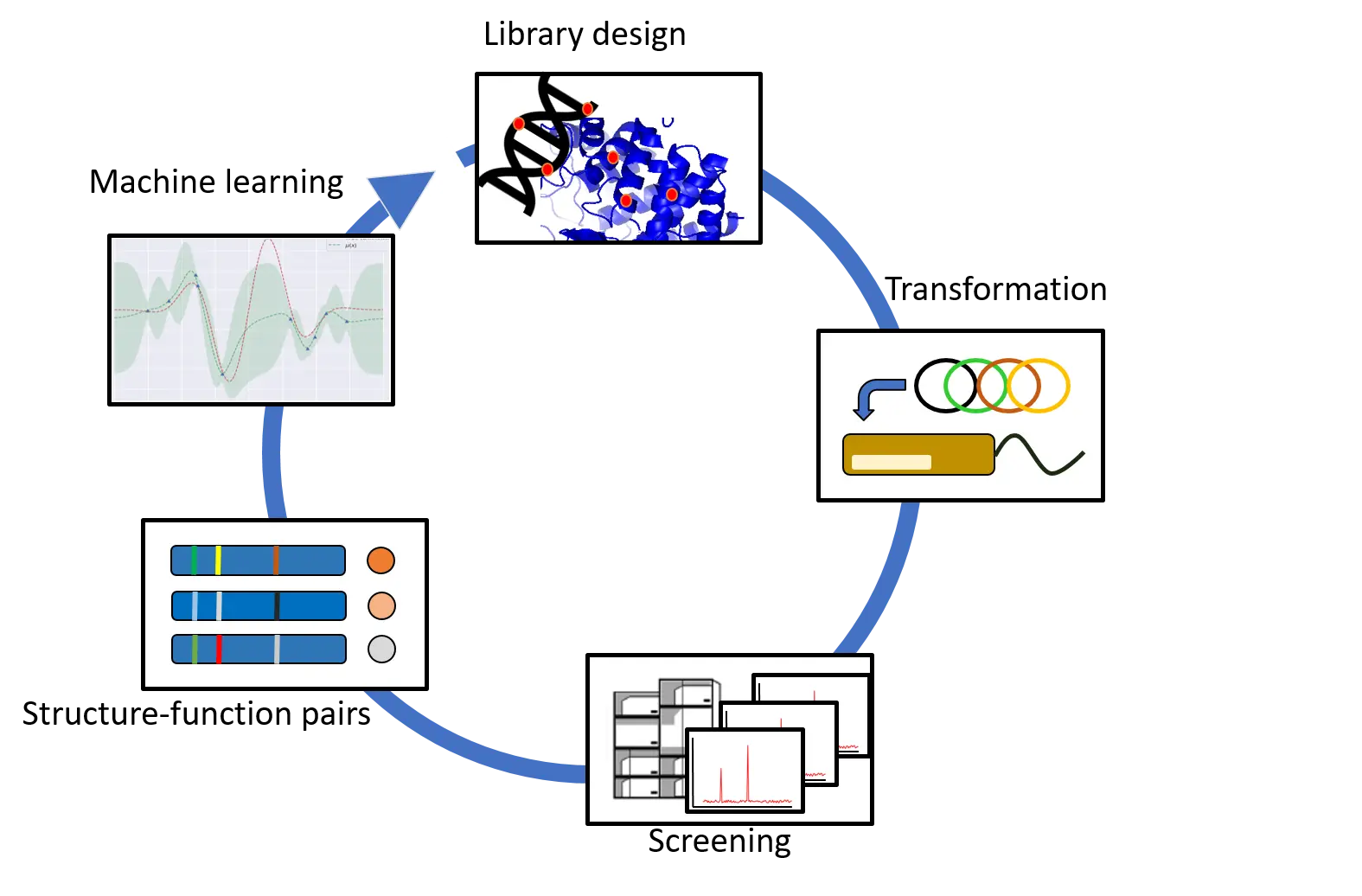
Das Screening grosser Enzymbibliotheken bei der Evolution von Proteinen ist zeitaufwendig und die komplette Durchmusterung der Bibliothek häufig nicht möglich. Wir untersuchen den Einsatz von maschinellem Lernen, um aktivere Varianten aus einen Pool von modifizierten Proteinen zu identifizieren, indem wir Sequenz-Funktionsbeziehungen einer kleinen Anzahl aller möglichen Kombinationen in unserem Model nutzen.
Publikationen
- Honda Malca et al., 2024 Commun. Chem. 7: 46
- Buller et al, (2023) SCIENCE 382, 899
- Patsch et al., 2023 Comput. Struct. Biotechnol. J. 21, 4488
- Giger & Buller, 2023 CHIMIA 77, 395
- Patsch & Buller 2023 CHIMIA 77, 116
- Büchler et al., 2022 Helv. Chim. Acta 106, e202200128
- Voss et al. 2022 ChemCatChem, e202201115
- Büchler et al., 2022 Nat. Commun. 13: 371
Roboter-assistiertes Enzym-Engineering

Das Screening grosser Enzymbibliotheken ist sehr arbeitsintensiv und stellt daher einen erheblichen Engpass bei der Optimierung von Proteinen dar. Mit unserer massgeschneiderten Roboterplattform können wir den Screening-Workflow automatisieren, von der Kultivierung der relevanten Bakterienstämme bis hin zur Durchführung der biokatalytischen Analysen. Die Automatisierung durch die Roboterplattform erhöht den Durchsatz im Screening drastisch und ermöglicht grosse Projekte der gerichteten Evolution.
Publikationen
- Honda Malca et al., 2024 Commun. Chem. 7: 46
- Buller et al, (2023) SCIENCE 382, 899
- Patsch et al., 2023 Comput. Struct. Biotechnol. J. 21, 4488
- Büchler et al., 2022 Helv. Chim. Acta 106, e202200128
Enzymfamilien
α-Ketoglutarat-abhängige Oxygenasen
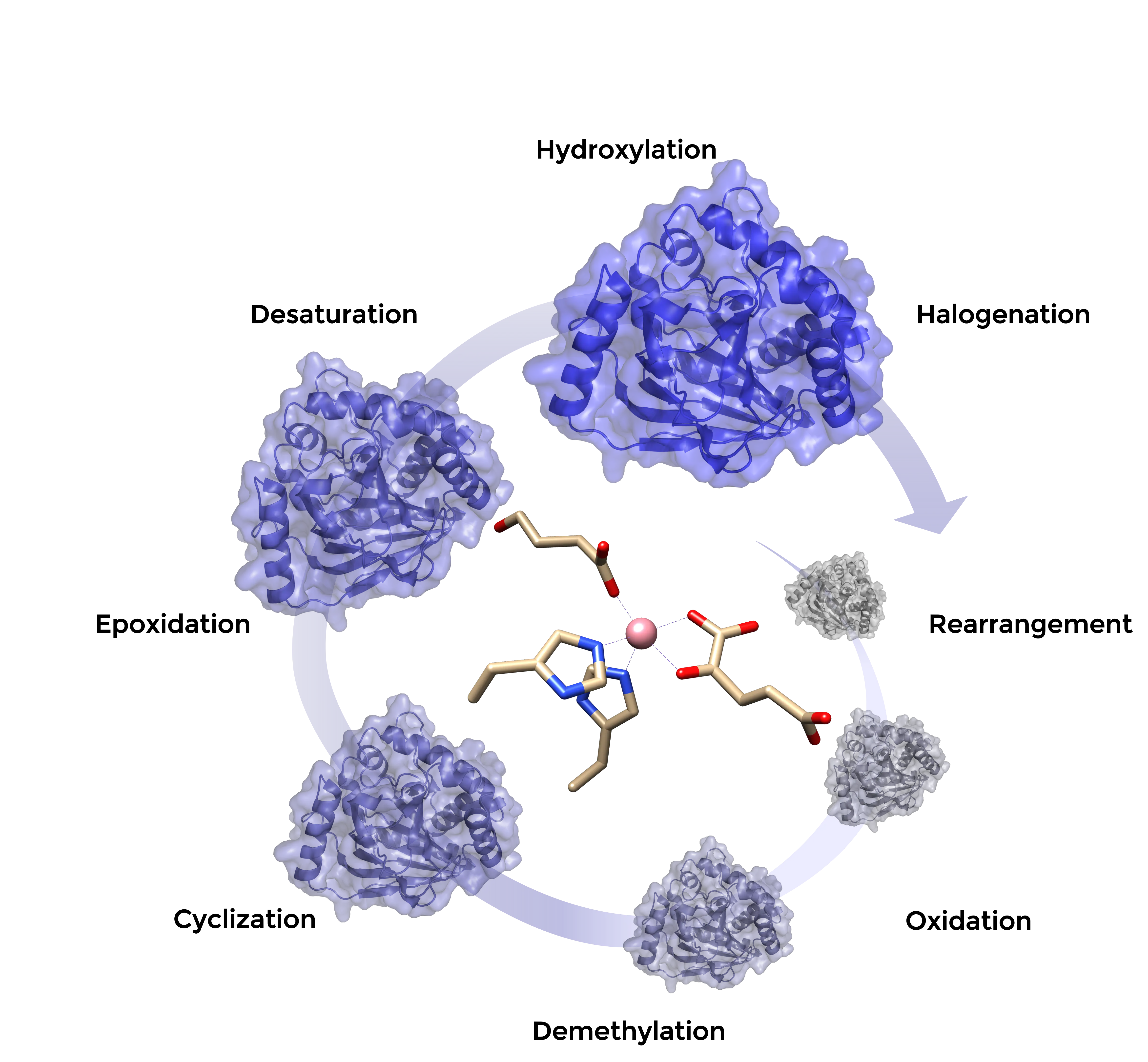
Die selektive Modifizierung nicht-aktivierter C-H-Bindungen stellt in der organischen Synthese oft eine Herausforderung dar. Wir erforschen das biokatalytische Potenzial der Fe(II)/α-Ketoglutarat-abhängigen Oxygenasen, um eine vielseitige biokatalytische «Toolbox» für die C-H-Funktionalisierung bereitzustellen. Diese Enzymfamilie katalysiert eine Reihe biologisch wichtiger Reaktionen, darunter Hydroxylierungen, Desaturierungen und Oxidationsreaktionen, auf Kosten des Cofaktors α-Ketoglutarat. Enzym-Engineering ermöglicht die Erweiterung der Anwendungsmöglichkeiten dieser Enzyme und die zielgerichteten Modifikation interessanter Moleküle.
Publikationen
- Honda Malca et al., 2024 Commun. Chem. 7: 46
- Papadopoulou et a., 2022 Biochemistry 62, 229
- Büchler et al., 2022 Nat. Commun. 13: 371
- Meyer et al. 2021 ACS Catal. 11: 6261
- Voss et al. 2021 ChemCatChem 13: 1
- Frey et al., 2019 Curr. Opin. Biotechnol. 60: 29
- Peters et al., 2019 Catalysts 9: 221
Halogenasen
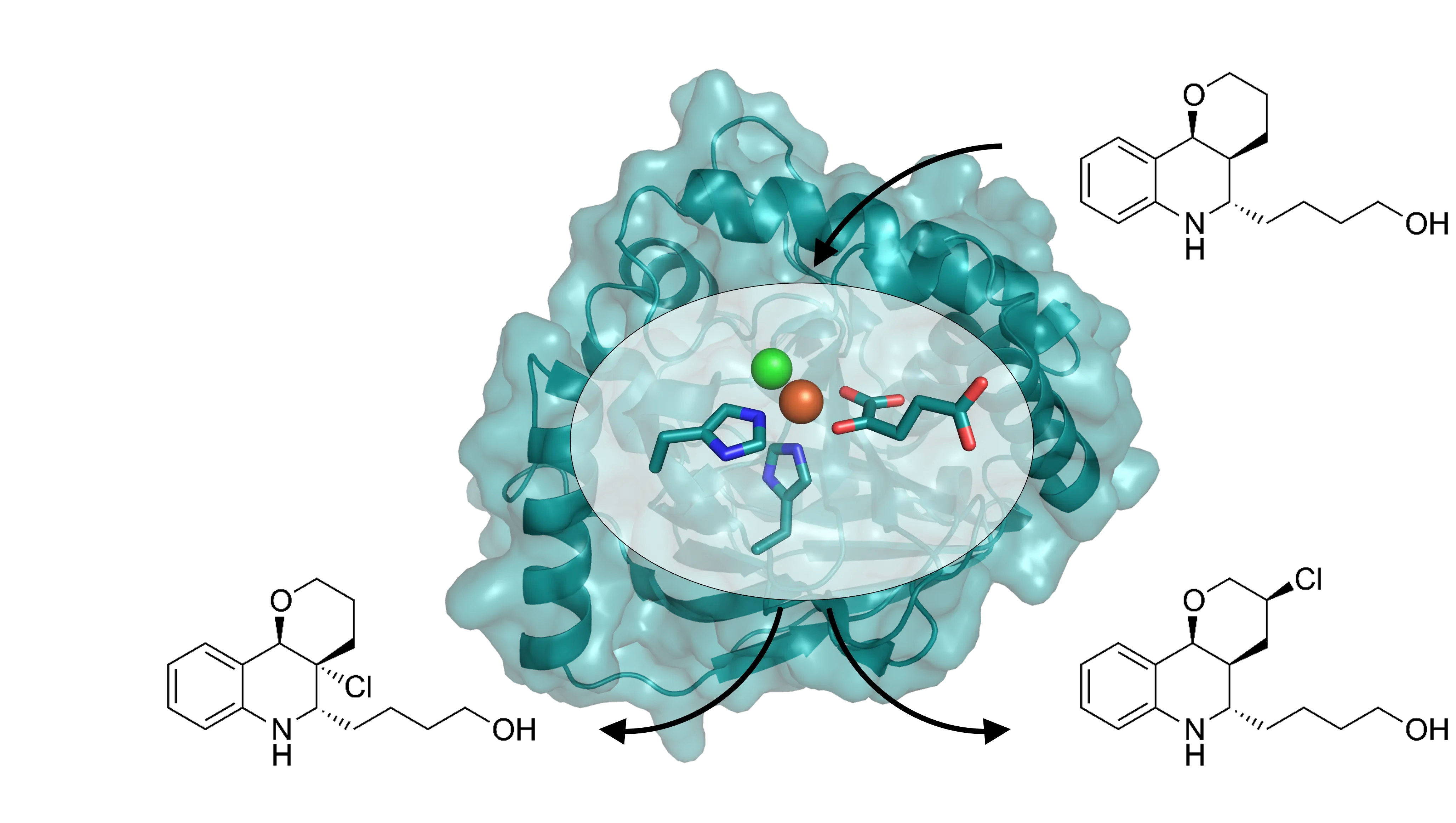
Halogenierung wird für industrielle Prozesse häufig nicht in Betracht gezogen, da die Reaktionsbedingungen in der Regel schwierig zu kontrollieren sind. Die biokatalytische Halogenierung ist hingegen eine elegante Alternative für die sichere und selektive Installation von Halogenatome in bioaktive Moleküle. Gegenwärtig verfügbare Halogenasen sind oftmals instabil und das Substratspektrum dieser Enzyme eingeschränkt. Wir nutzen Methoden des Enzym-Engineerings zur Entwicklung robuster Biokatalysatoren mit breitem Einsatzgebiet für die aliphatische und aromatische Halogenierung für den akademischen und industriellen Einsatz.
Publikationen
- Patsch & Buller Chimia 77, 116
- Hegarty et al., 2023 Curr. Opin. Green Sustain. Chem. 41, 100786
- Büchler et al., 2022 Helv. Chim. Acta 106, e202200128
- Voss et al. 2022 ChemCatChem, e202201115Hegarty
- Papadopoulou et a., 2022 Biochemistry 62, 229
- Büchler et al., 2022 Nat. Commun. 13: 371
- Papdopoulou et al. 2021 ChemCatChem 13: 3914
- Voss et al. 2021 ChemCatChem 13: 1
- Voss et al. 2020 Chem. Eur. J. 26: 7336
- Hayashi et al., 2019 Angew. Chem. 58: 18535
- Buechler et al. 2019 Catalysts 9: 1030
- Frey et al., 2019 Curr. Opin. Biotechnol. 60: 29
Squalen-Hopen-Cyclasen (SHCs)
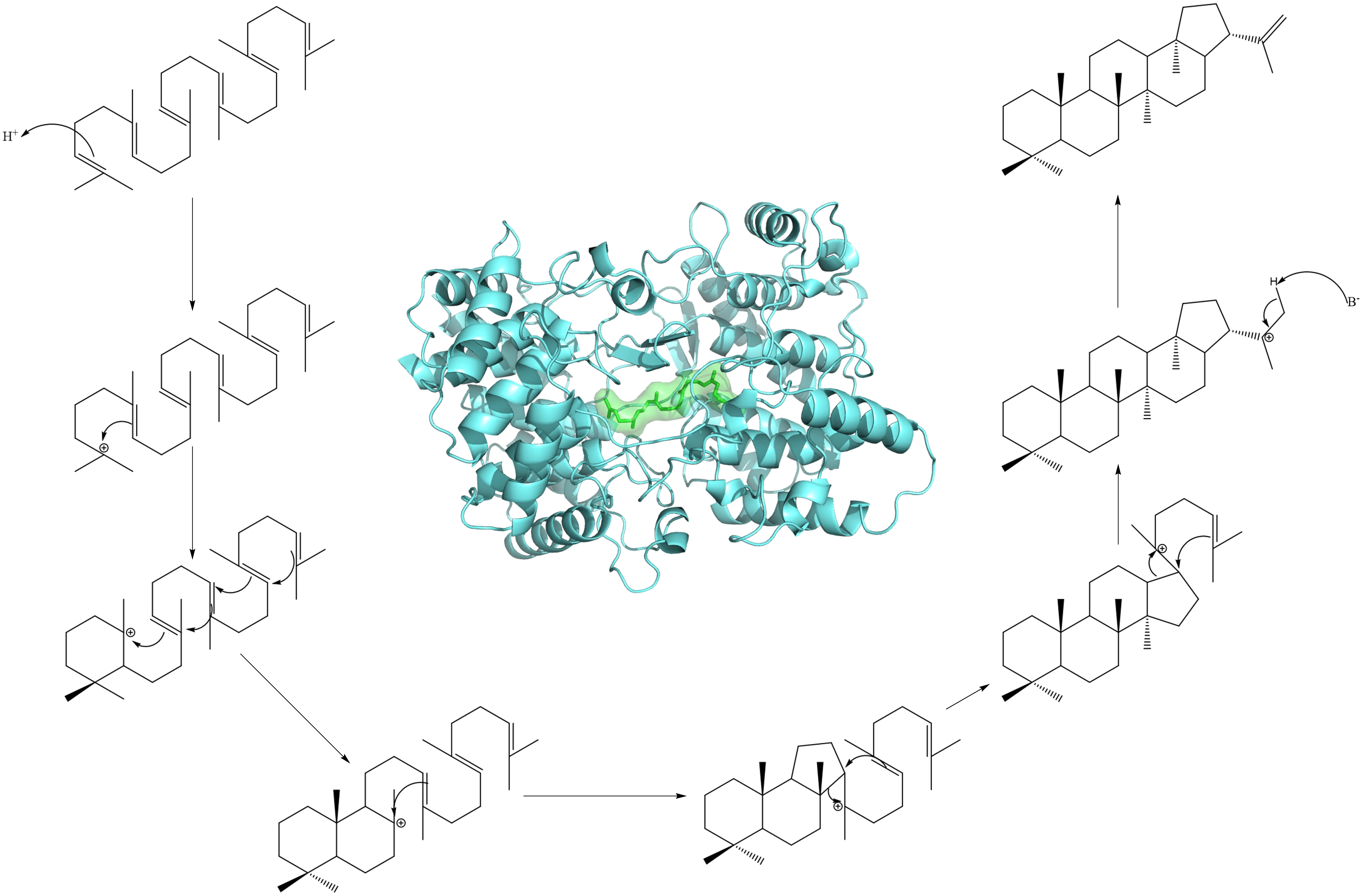
SHCs katalysieren eine der komplexesten biochemischen Reaktionen: die Ringschluss-Reaktionen von Squalen zu Hopen und Hopanol durch die Knüpfung von fünf neuen C-C-Bindungen. Diese Enzyme besitzen ein hohes Mass an Promiskuität und ermöglichen somit die Umsetzung von industriell relevanten Duft- und Aromastoffen. Wir haben eine umfangreiche «Toolbox» von SHCs entwickelt und erforschen derzeit den Substratumfang und die Reaktionseigenschaften dieser Enzyme und optimieren diese durch gerichtete Evolution.
Publikationen
- Patsch et al., 2023 Comput. Struct. Biotechnol. J. 21, 4488
- Eichenberger et al. 2021 Angew. Chem. 60: 26080
- Peters et al., 2019 Z. Naturforsch. C 74: 63
Ene-Reduktasen

Ene-Reduktasen katalysieren die asymmetrische Reduktion aktivierter C=C-Bindungen, wodurch bis zu zwei neue Stereozentren entstehen können. Unsere biokatalytische «Toolbox» an Ene-Reduktasen wird ständig erweitert und hinsichtlich der Modifizierung von chemischen Verbindungen getestet, die für die chemische Industrie von Interesse sind.
Publikationen
- Papadopoulou et al., 2022 Org. Process. Res. Dev. 26, 2102-2110
- Aregger et al., 2020 Catalysts 10: 254
- Peters et al., 2019 ChemBioChem 20: 1569
- Peters et al., 2019 Z. Naturforsch. C 74: 63
Mikrobielle Epimerasen
Die Zunahme antibiotikaresistenter Bakterien stellt eine grosse Bedrohung für die globale Gesundheit dar. Antimikrobielle Peptide sind vielversprechende Alternativen zur Bewältigung dieser Krise, wobei die klinische Anwendung der Peptide wegen ihres raschen Abbaus im Organismus eingeschränkt ist. Die (bio)chemische Modifikation kann zu stabileren und aktiveren Peptiden führen, welche den Nachteil des schnellen Abbaus im Organismus umgehen. In Kooperation mit Rémy Bruggmann und Vincent Perreten (Universität Bern) entwickeln wir eine biokatalytische «Toolbox» von Epimerasen für die spezifische Modifikationen von Peptiden.
PETase
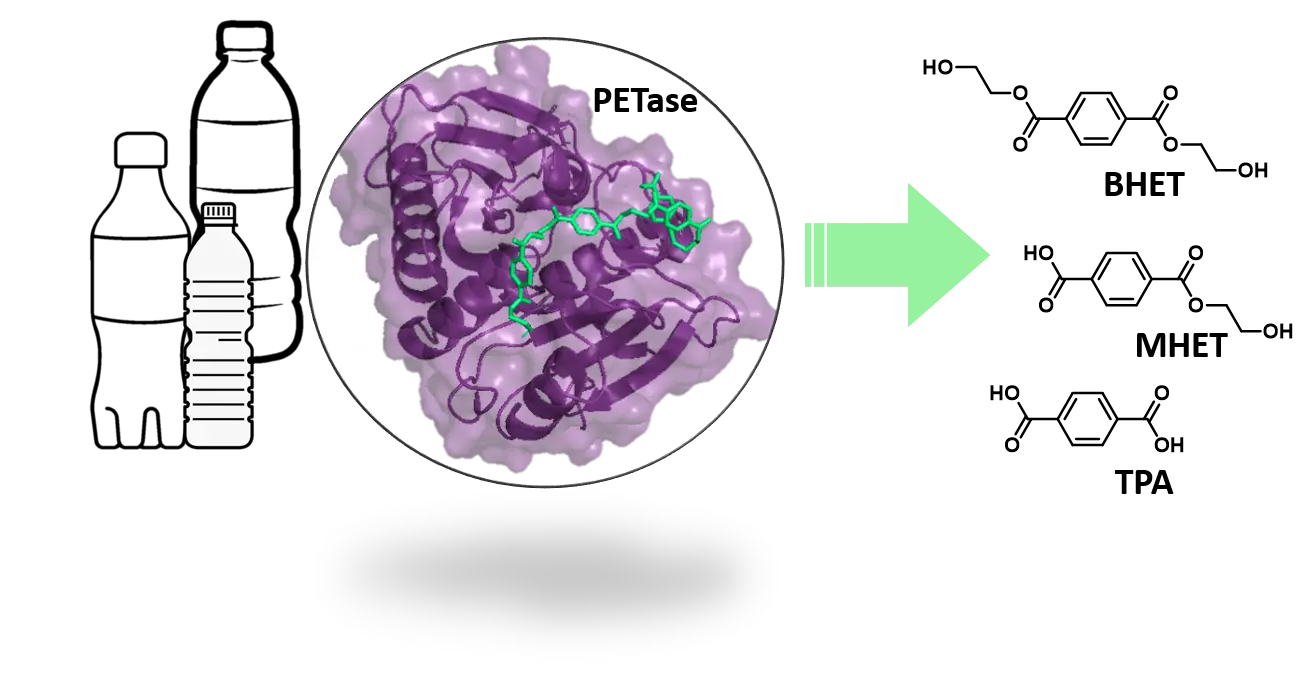
Kunststoff ist aus unserem Alltag nicht mehr wegzudenken. Mit zunehmender Produktion und Verwendung erhöht sich jedoch auch die Menge von Kunststoffabfall - eine Gefahr für Umwelt und Gesundheit. PET-Recycling mittels enzymatischem PET-Abbau hat sich als umweltfreundliche Alternative herausgestellt und könnte, wenn weiter verbessert, eine neue Strategie für das allgemeine Kunststoffabfallmanagement werden
Publikation
- Papadopoulou et al. 2019, Chimia 73: 743